Периодический закон и периодическая система химических элементов Д. И. Менделеева
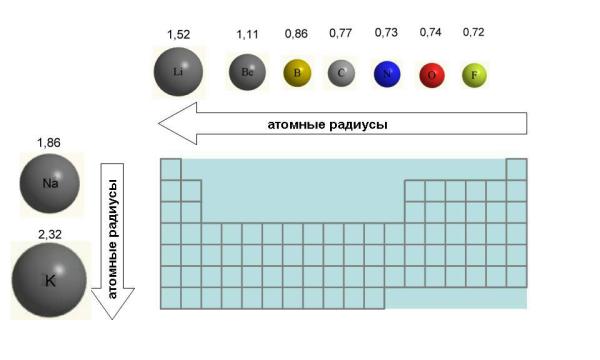
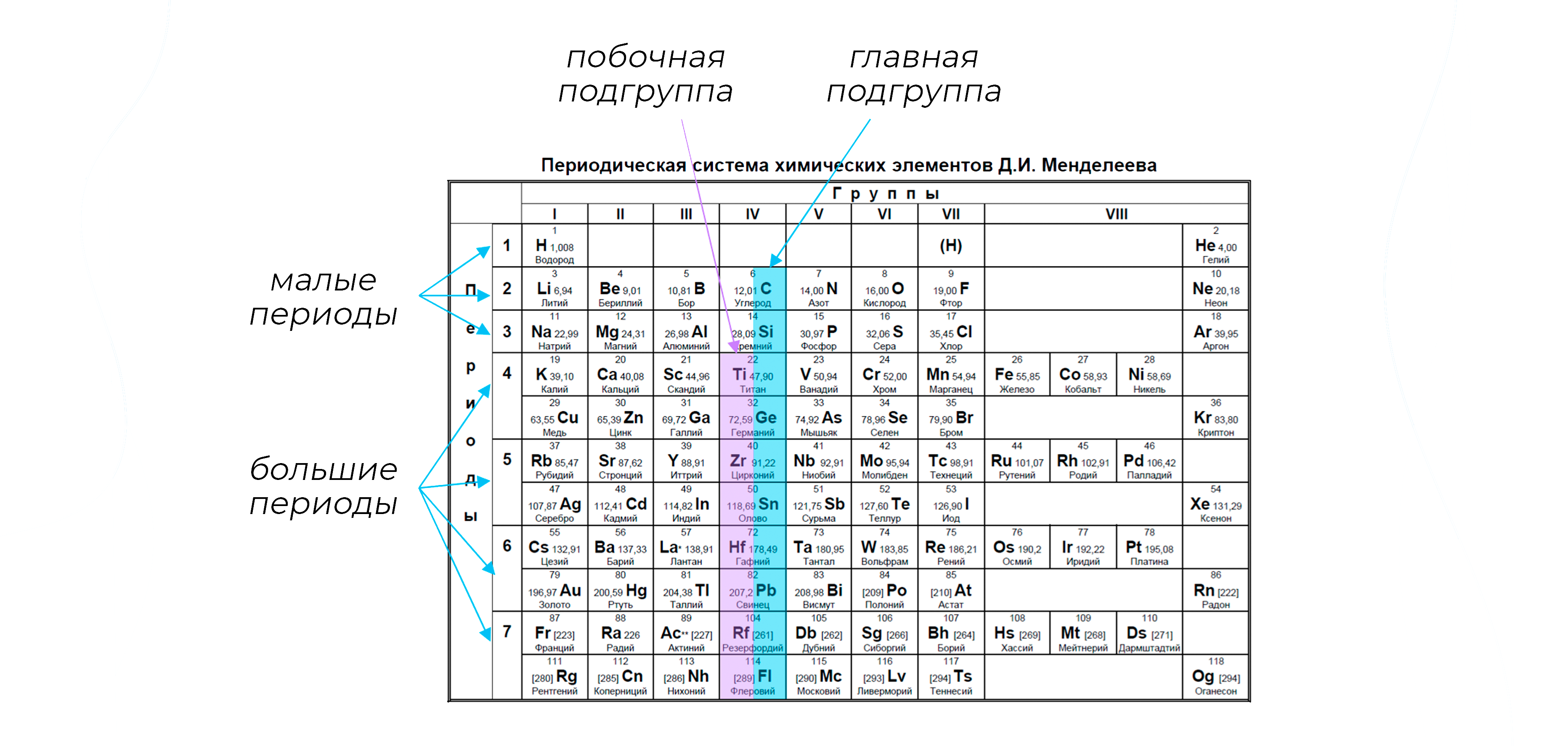
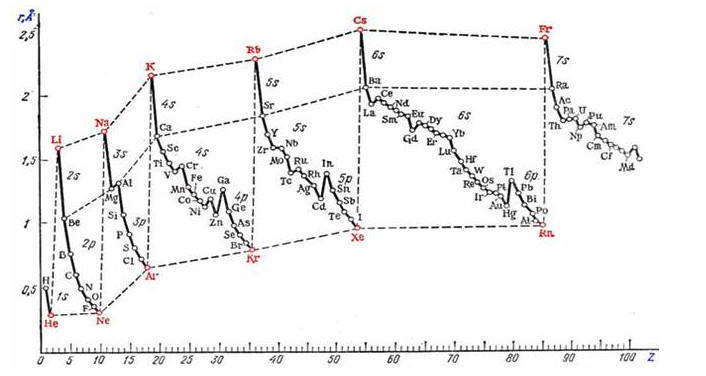
Объяснить и предсказать химические свойства веществ металлические и неметаллические, окислительно-восстановительные и кислотно-основные можно, используя сведения о периодическом изменении свойств атомов по мере увеличения заряда их ядра, важнейшие из которых — радиус атома, значения его электроотрицательности и степени окисления. Проанализируем, как эти свойства зависят от электронного строения атомов. Периодичность изменения радиусов атомов элементов.
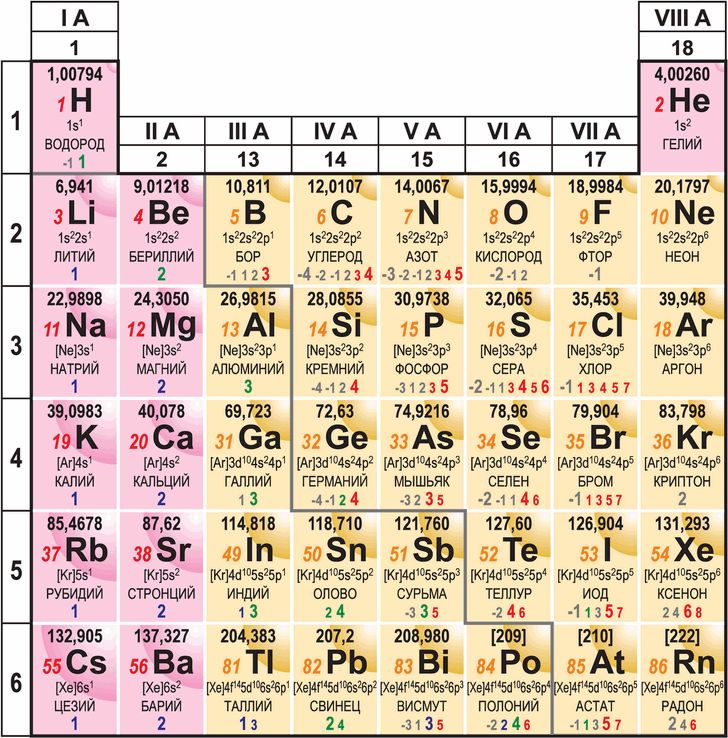
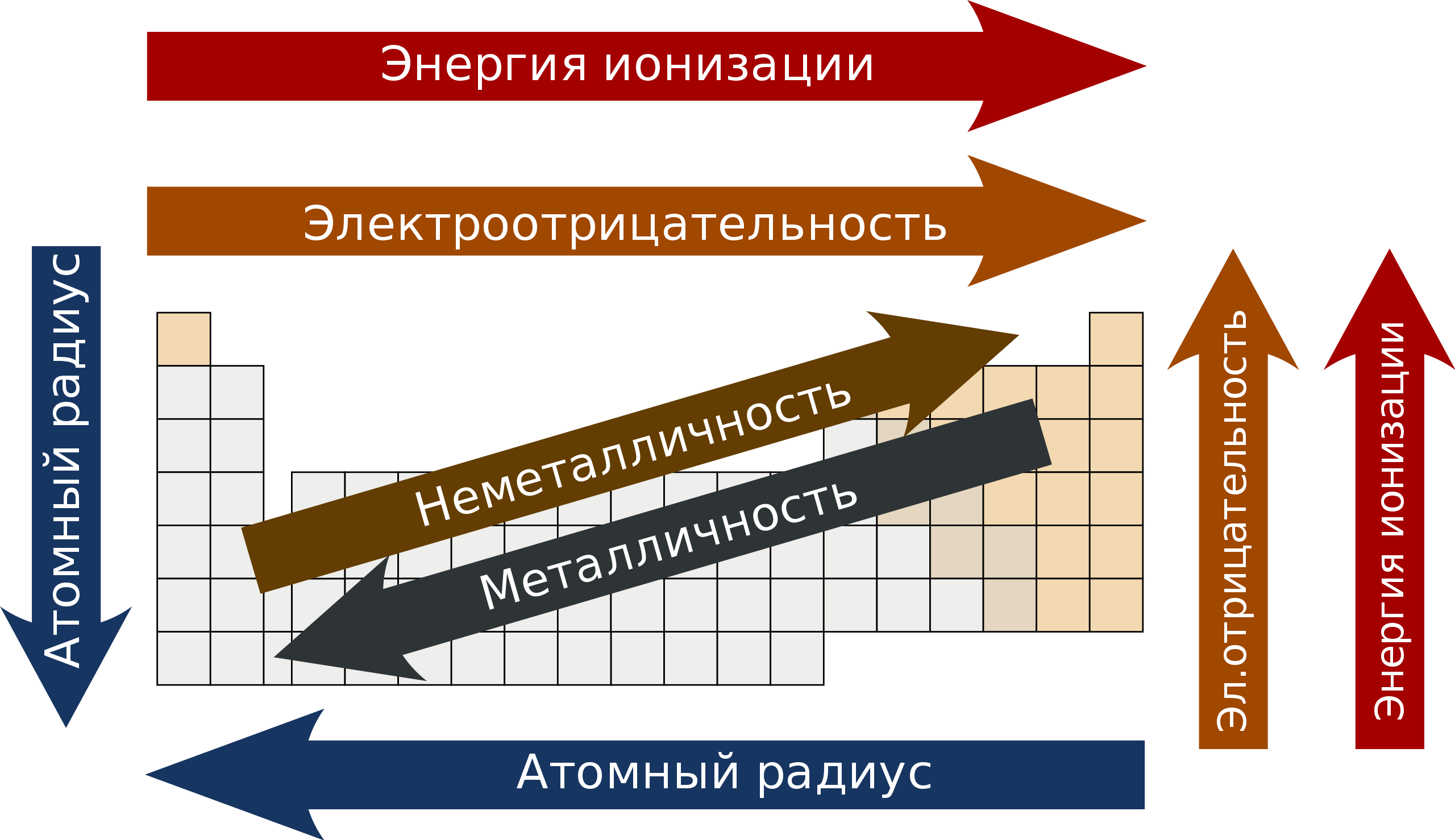
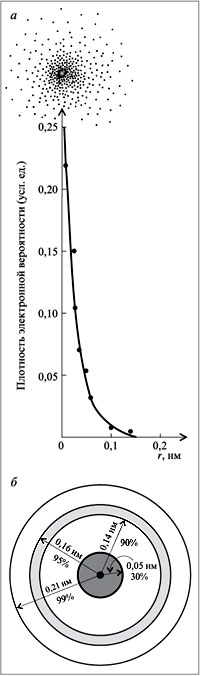








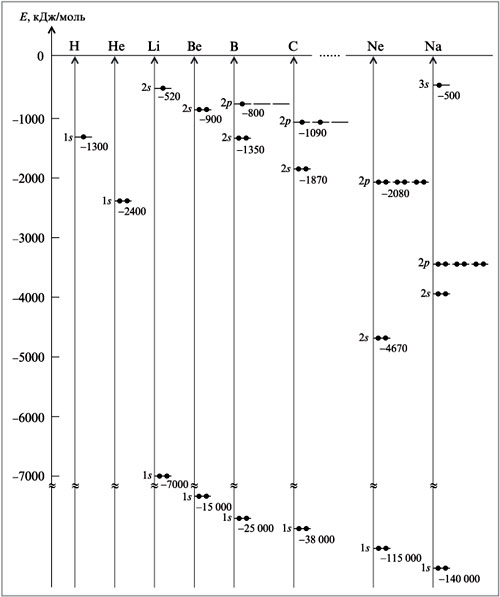
Атом не имеет точного размера, поскольку его электронная плотность сильно размыта. Поэтому радиус атома — условное понятие, зависящее от способа его определения. Различают ковалентные, металлические, ван-дер-ваальсовы и ионные радиусы. К числу важнейших свойств элементов, определяемых электронным строением атома, относятся радиусы атомов и ионов, потенциалы ионизации, сродство к электрону, электроотрицательность, степени окисления элементов.




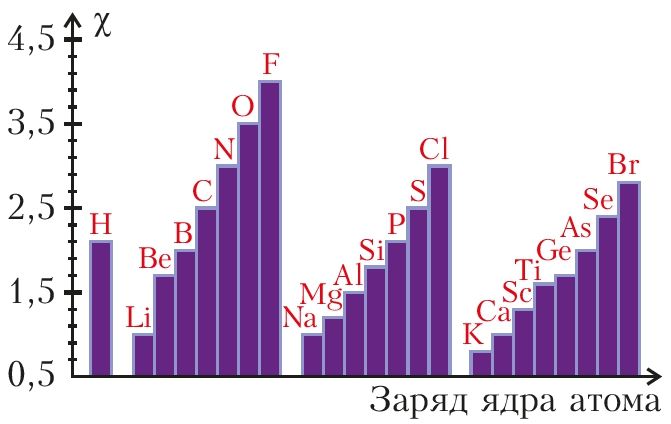



Поскольку атом не имеет определенных размеров, атомные радиусы представляют собой в известной мере условные величины. Различают орбитальные и эффективные атомные радиусы. Орбитальные радиусы r орб - это расстояния от ядра до главного максимума функции радиального распределения электронной плотности. Эти величины рассчитаны квантово-механическими методами для всех элементов периодической системы.